
Día Mundial del Trastorno del Espectro Alcohólico Fetal
Cada 9 de septiembre se busca concientizar sobre los efectos irreversibles del consumo de alcohol durante el embarazo y la importancia de prevenir el Trastorno del Espectro Alcohólico Fetal.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) detuvo la fabricación de medicamentos y otros productos médicos de la empresa HLB Pharma Group S.A., así como de su asociado, Laboratorios Ramallo S.A., y prohibió la venta de todos sus artículos en el territorio nacional.
Salud y Bienestar14 de mayo de 2025 Bajo la Lupa Noticias
Bajo la Lupa NoticiasLa Disposición 3158/2025 fue dada a conocer en el Boletín Oficial y responde a diversas faltas graves y constantes halladas en la calidad, seguridad y trazabilidad de los fármacos producidos. Uno de los productos afectados fue un lote del "Fentanilo HLB" que resultó contaminado.
Este laboratorio, objeto de controversia, está implicado en varias investigaciones judiciales aún en curso y en la distribución de la vacuna rusa Sputnik V contra el COVID-19.
La ANMAT presentó varios motivos para suspender la producción de este laboratorio. Uno de los principales señala: “El reporte recibido informó sobre la contaminación microbiana reportada en 18 pacientes por la administración del producto FENTANILO HLB, que se aplica a pacientes hospitalizados de alta vulnerabilidad a quienes el uso del producto contaminado puede acarrearles la muerte”.
Muertes con poca cobertura mediática
Estos sucesos, que tuvieron poca cobertura mediática, habrían causado la muerte de varios pacientes y afectado a otros en las ciudades de La Plata, en Buenos Aires, y Rosario, en Santa Fe. La seriedad del asunto llevó a las autoridades de salud a presentar una denuncia penal contra los responsables de la compañía, con el fin de que la Justicia determine posibles implicaciones legales.


Hasta la fecha, la ANMAT ha impuesto diversas medidas punitivas contra HLB Pharma durante este año. En febrero, se vetó la distribución de dopamina debido a la falta de trazabilidad. En abril, se ordenó la retirada de lotes de Propofol por sospechas de falsificación, y también se prohibieron diclofenac y morfina por contaminación cruzada de alto riesgo. Por último, el 8 de mayo se suspendió la distribución de fentanilo.
El 24 de febrero, la ANMAT determinó que Laboratorios Ramallo S.A. “no podrá continuar con su actividad productiva debido a que durante un proceso de inspección fueron detectadas deficiencias significativas, clasificadas como críticas y graves, en la Gestión del Sistema de Calidad Farmacéutico (Validación de procesos, documentación, entre otros), en Producción, en Recursos Humanos, en Depósitos, en Control de Calidad, entre otros. Dichos incumplimientos comprometen la calidad, seguridad y eficacia de los productos elaborados”.
De acuerdo con los documentos que circulan en los ámbitos oficiales, los empresarios Ariel García Furfaro y Jorge Salinas estarían relacionados con ambas compañías, quienes se hallan vinculados a la llamada “Mafia de los Medicamentos”. Esta red fue denunciada por la exministra de Salud y actual legisladora porteña, Graciela Ocaña, así como también por los expropietarios del Laboratorio Apolo, una empresa que cerró el 11 de abril de 2026.
En junio de ese mismo año, una explosión en una de las calderas de la planta de esta compañía en Rosario dejó a cinco personas heridas, una de ellas con heridas graves. Además, dicha empresa estuvo bajo investigación por presunto contrabando de suero proveniente de Paraguay.
Brote de neumonía
La Disposición 3158/2025 de la ANMAT fue implementada tras el hallazgo de un brote de neumonía causado por Klebsiella pneumoniae en pacientes internados en hospitales de La Plata y Rosario.
Fuentes oficiales informaron que dicha bacteria se encontró en un lote del medicamento Fentanilo producido por HLB Pharma, específicamente en el producto denominado "FENTANILO HLB / FENTANILO (CITRATO)", concentración 0,05 mg/ml, en forma de solución inyectable, lote 31202, vencimiento SEP-26, presentación de 100 ampollas de 5 ml, Certificado N°53.100. Este lote fue retirado de circulación por la ANMAT el 8 de mayo pasado.
En las revisiones llevadas a cabo por el Instituto Nacional de Medicamentos (INAME) en las instalaciones de San Isidro y Ramallo, se constató que al menos 69 lotes de soluciones parenterales de volumen reducido fueron envasados en ampollas plásticas no aprobadas, sin la validación adecuada de los procesos, sin estudios de estabilidad y sin la documentación de respaldo correspondiente a la producción.
Además, se descubrió que ciertos medicamentos, como “Propofol HLB” y “Dopamina HLB”, no estaban registrados en el Registro de Especialidades Medicinales (REM) y carecían de trazabilidad.
De acuerdo con lo señalado por representantes de La Libertad Avanza a colegas de Infobae, la acusación penal que están preparando las autoridades de salud, junto con las acciones administrativas tomadas por la ANMAT, “se fundamenta en el riesgo sanitario crítico que implican estos productos para la población”. También remarcaron que “la presencia en el mercado de medicamentos elaborados en condiciones irregulares, sin trazabilidad ni respaldo de calidad, constituye una violación a la Ley N.º 16.463, que prohíbe la elaboración y distribución de productos impuros o ilegítimos”.

Cada 9 de septiembre se busca concientizar sobre los efectos irreversibles del consumo de alcohol durante el embarazo y la importancia de prevenir el Trastorno del Espectro Alcohólico Fetal.

Esta práctica, compartida en comunidades y respaldada por referencias científicas, se basa en combinar ingredientes comunes y accesibles con propiedades avaladas por especialistas.
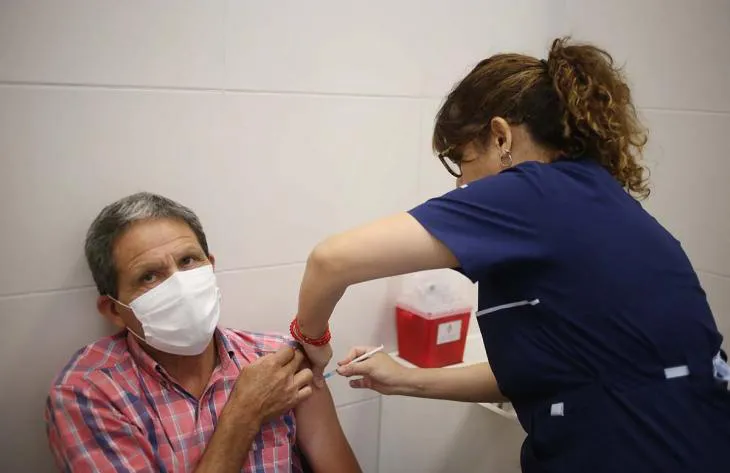
La inoculación como estrategia de prevención es la más importante después del agua potable en todo el mundo. El rol de la Brigada de Vacunación.

El Colegio Médico de Tucumán fue escenario de un encuentro científico de relevancia mundial: el Curso Internacional de Sueño, Soporte No Invasivo y Oxigenoterapia.

Cada 25 de agosto se conmemora en nuestro país el Día Nacional de Ayuda a la Persona Autista, una fecha instaurada en homenaje a la creación de la Asociación Argentina de Padres de Autistas (APADEA) en 1994.

El siniestro ocurrió en la tarde de este sábado sobre la nueva traza de la ruta nacional 38, cerca del puente del río Medina. La conductora, una mujer de 70 años, fue trasladada al hospital de Águilares y posteriormente recibió el alta médica.

La jubilación mínima subirá a $326.266,35 y, con el bono de $70.000, ningún beneficiario cobrará menos de $396.266,35. El organismo también informó que algunas fechas de cobro se modificarán por el feriado trasladado del 12 al 10 de octubre.

El Desafío Choromoro, válido por el campeonato Rural Bike, convocó a competidores de Tucumán y provincias vecinas, combinando actividad deportiva, promoción del turismo rural y una marcada participación de la comunidad local.

Un preceptor del instituto reportó mensajes anónimos que alertaban sobre un supuesto atentado contra docentes y directivos, previsto para el lunes 6 de octubre. La Fiscalía de Homicidios de Concepción interviene y se activó el protocolo de seguridad correspondiente.

En una serie de operativos simultáneos realizados en Concepción y Famaillá, la Policía de Tucumán logró desarticular varios puntos de venta de drogas. Ocho personas fueron aprehendidas y se secuestraron cocaína, marihuana, psicofármacos, dinero en efectivo y diversos elementos vinculados al narcomenudeo.